近日,为贯彻实施《医疗器械不良事件监测和再评价管理办法》,落实医疗器械注册人备案人主体责任,加强医疗器械不良事件监测检查工作,国家药监局组织制定《医疗器械注册人备案人开展不良事件监测工作检查要点》。
《通知》全文如下:
国家药监局综合司关于印发医疗器械注册人备案人开展不良事件监测工作检查要点的通知
药监综械管〔2021〕43号
各省、自治区、直辖市药品监督管理局,新疆生产建设兵团药品监督管理局:
为贯彻实施《医疗器械不良事件监测和再评价管理办法》,落实医疗器械注册人备案人主体责任,加强医疗器械不良事件监测检查工作,国家药监局组织制定了《医疗器械注册人备案人开展不良事件监测工作检查要点》,以规范和指导对医疗器械注册人备案人的质量管理体系检查、不良事件监测专项检查、日常监督检查等工作。现印发你们,请结合工作实际贯彻执行。
附件:医疗器械注册人备案人开展不良事件监测工作检查要点
国家药监局综合司
2021年4月6日
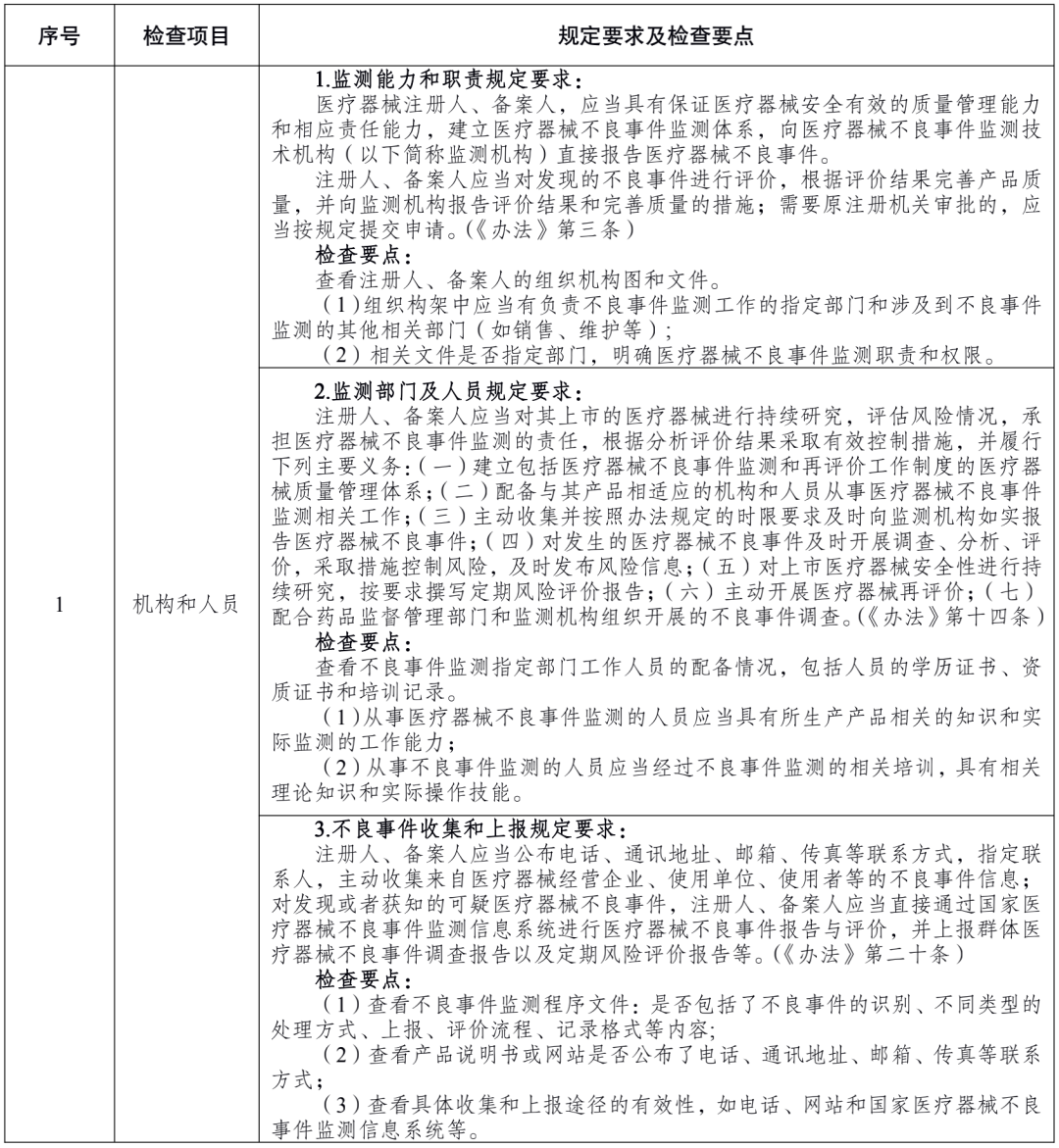
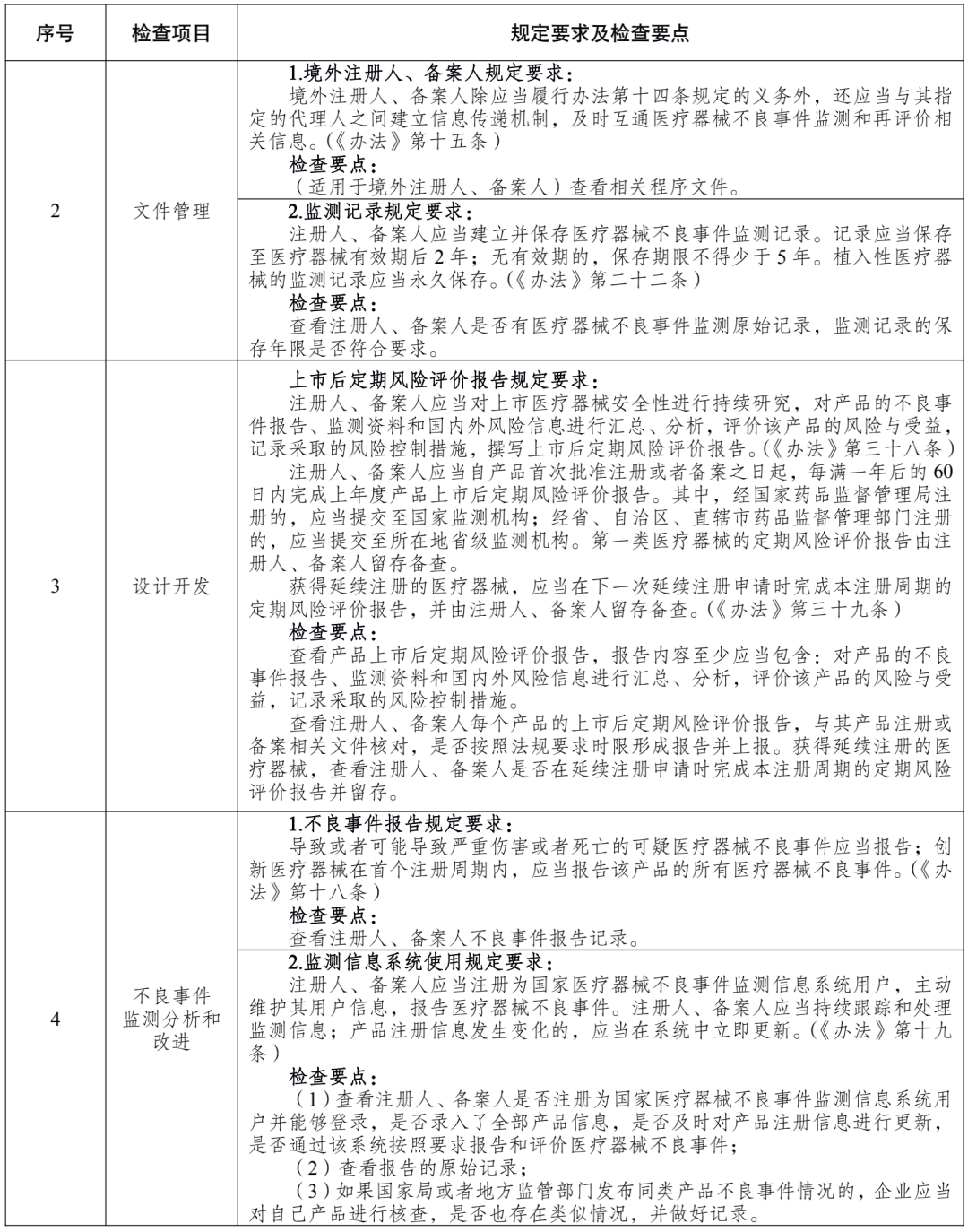
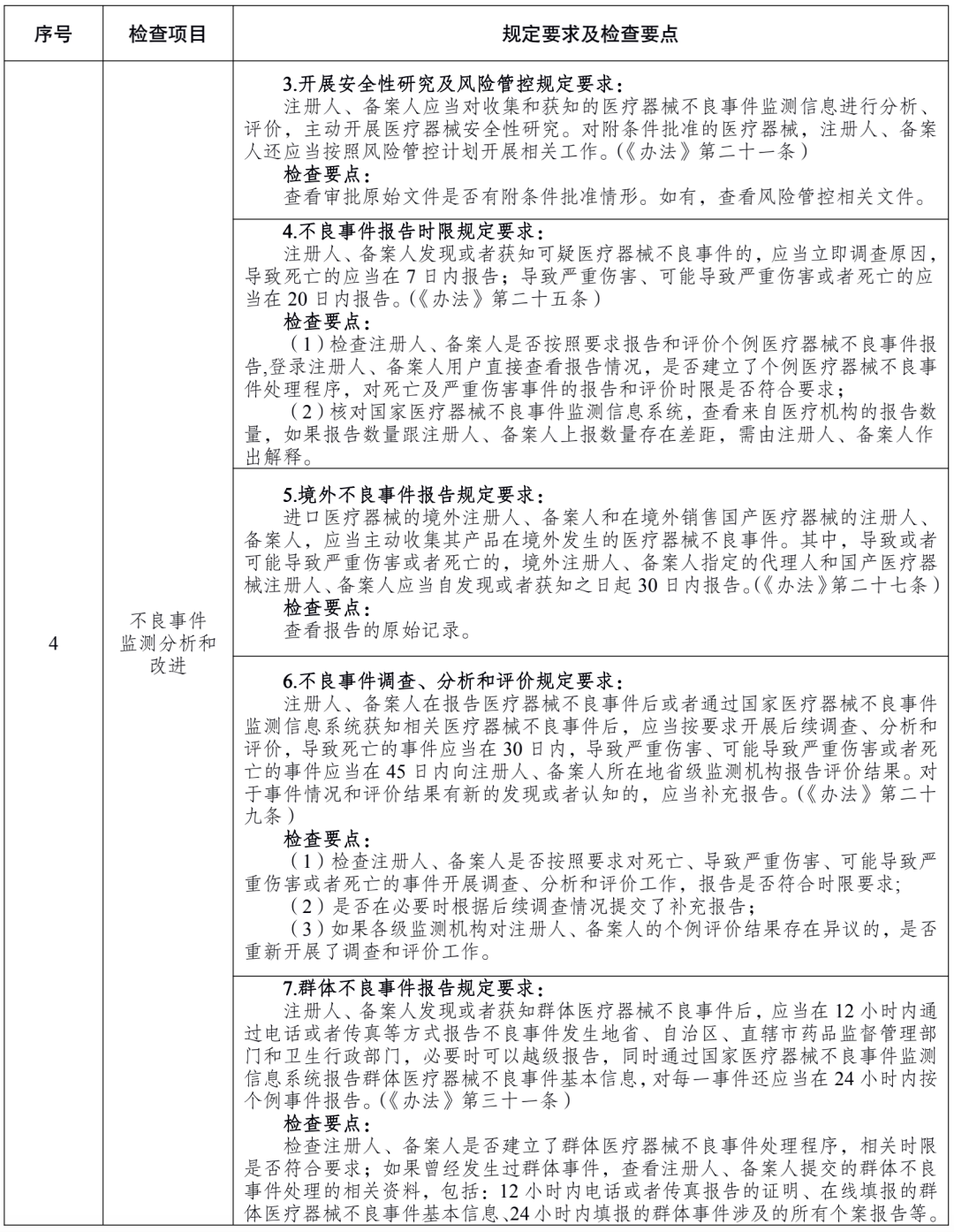
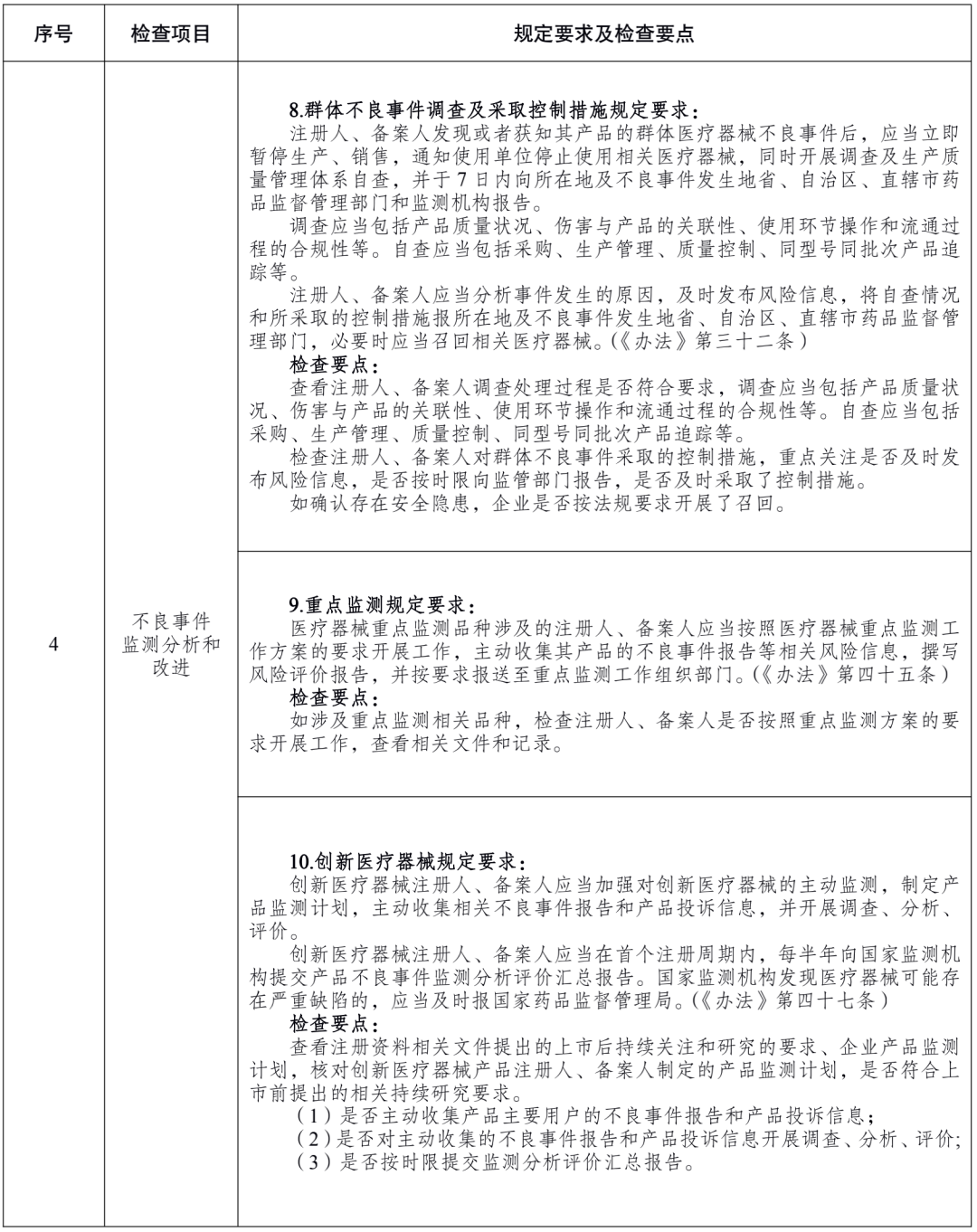
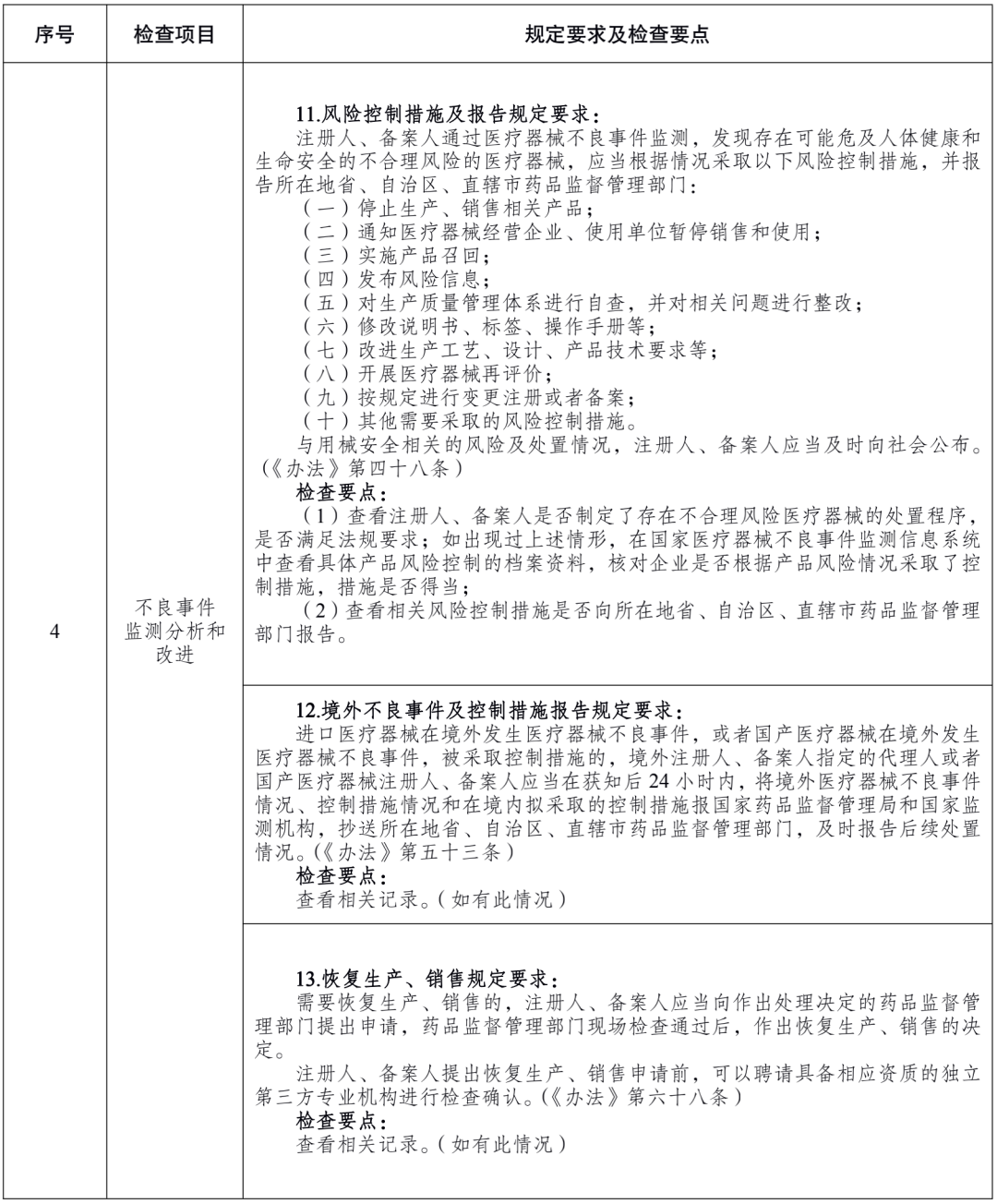
附件 医疗器械注册人备案人开展不良事件监测工作检查要点:

Copyright 2020 yaoxie.com 互联网药品信息服务资格证书(闽)-经营性-2019-0023 互联网药品交易服务资格证书-国A20150004
闽ICP备14018699号-4 增值电信业务经营许可证 闽B2-20140006 闽公网安备35030502000131号 营业执照:91350300056126227U
医疗器械网络交易服务第三方平台备案凭证 备案编号:(闽)网械平台备字(2018)第00001号
药品网络交易第三方平台备案凭证 (闽)网药平台备字 (2023) 第000004-000号