“医疗器械出口资质最全盘点,口罩、额温枪……”
24小时新增10000余例,全球疫情蔓延迅速
新冠肺炎“大流行”下,各国的疫情情况仍不容乐观。
最新数据显示,截止到北京时间3月18日12时,除中国以外共有159个国家和地区累计确诊114963例,累计死亡4675例。其中,意大利的累计确诊病例增长至31506例,死亡病例达到2503例。截止到北京时间3月19日上午,全球新冠肺炎确诊病例累计达到215955例,死亡病例8749例。

境外急需大量医疗物资,大批械企出口订单暴增
随着意大利、法国、西班牙等国家新增确诊病例的不断暴增,境外的医疗物资一时间十分紧缺,我国多家医疗器械公司也收到了不少来自国外的医疗物资求购订单。
据统计,现阶段境外各国急需医疗物资产品主要有口罩、消毒包、额温枪、温度计、呼吸机、监护仪、检验试剂盒......
而值得注意的是,由于各国的标准不同,因此医疗器械出口到不同的国家,其出口的资质要求也是不同的。
医疗器械出口资质一览,口罩、额温枪......
小编根据各大政府网站以及相关公众平台的公开报道整理出了一份医疗器械出口资质汇总,仅供大家参考!如有变动,请以官方要求为准。
01、疫情防控物资申报规范

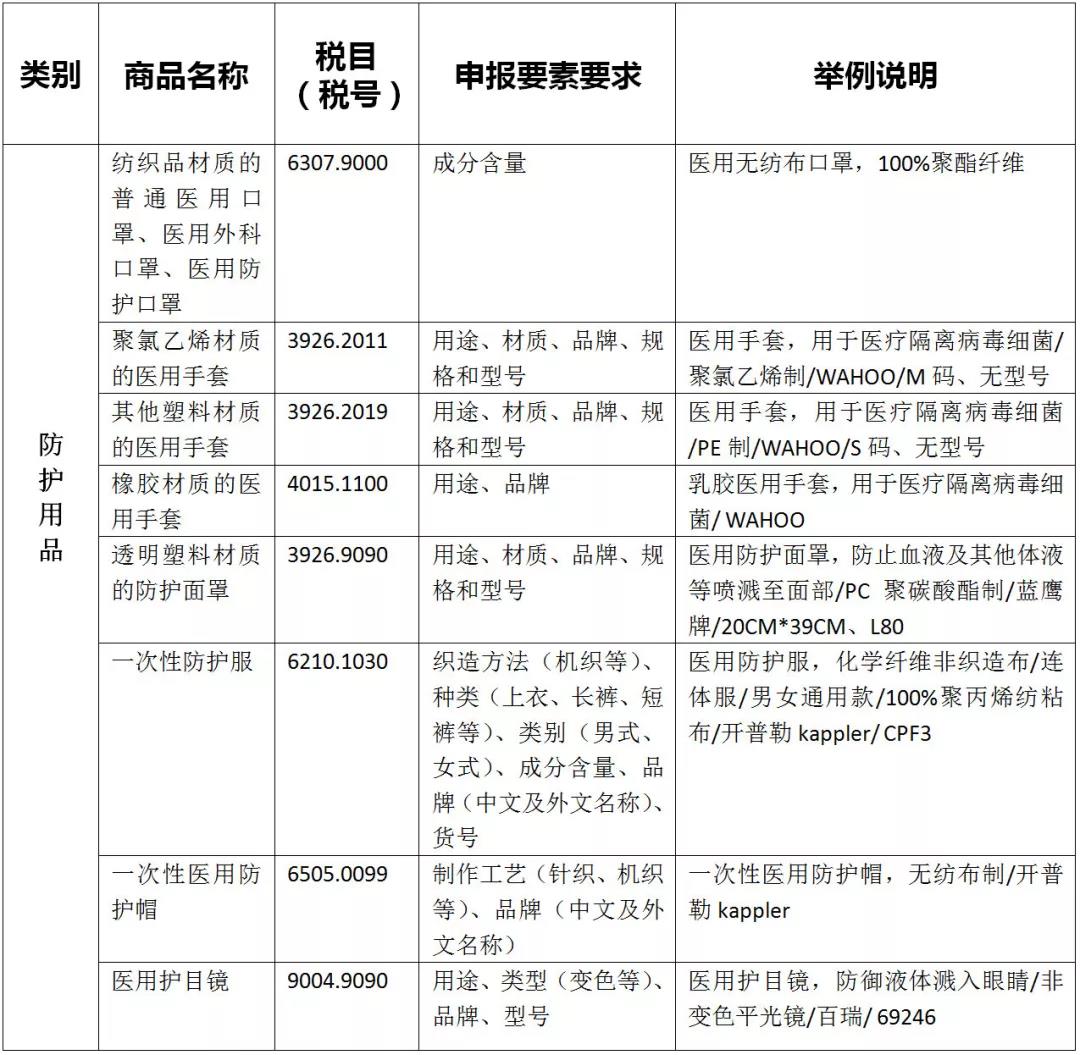

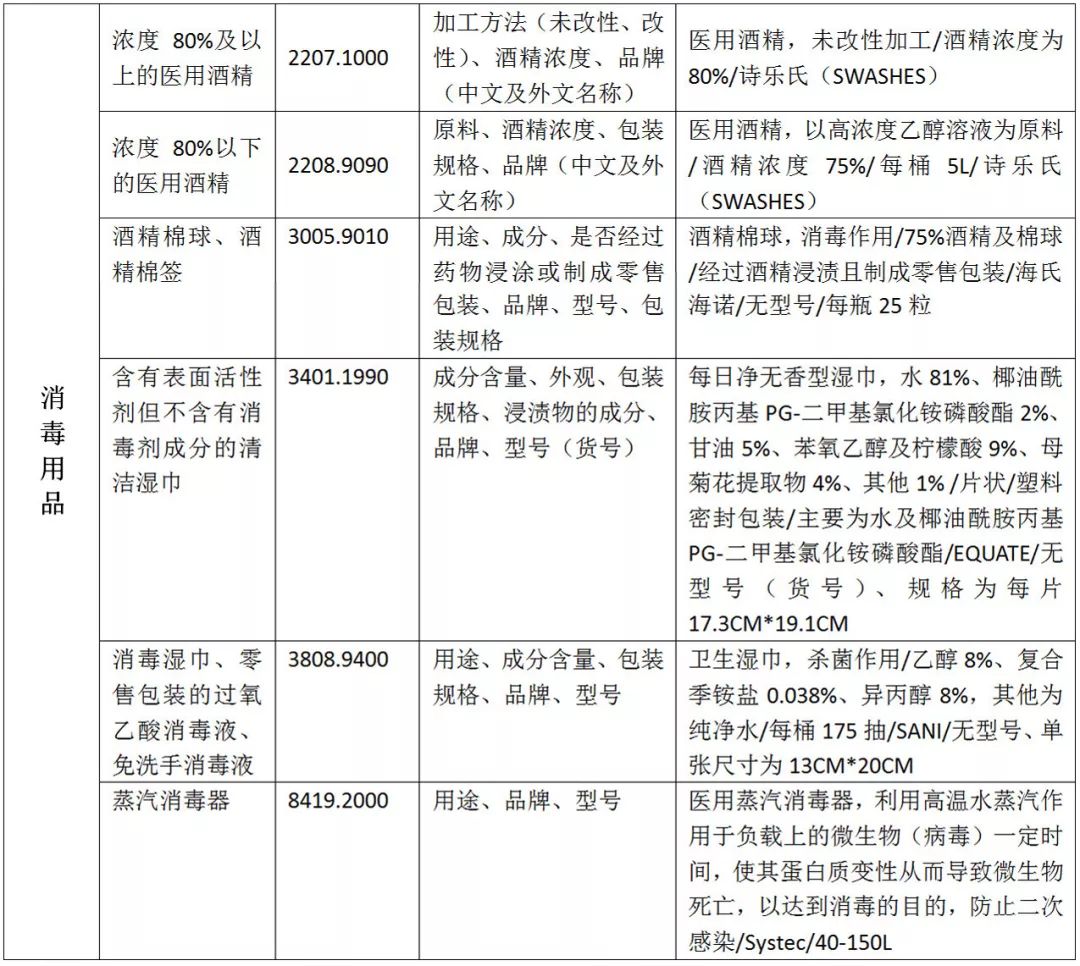

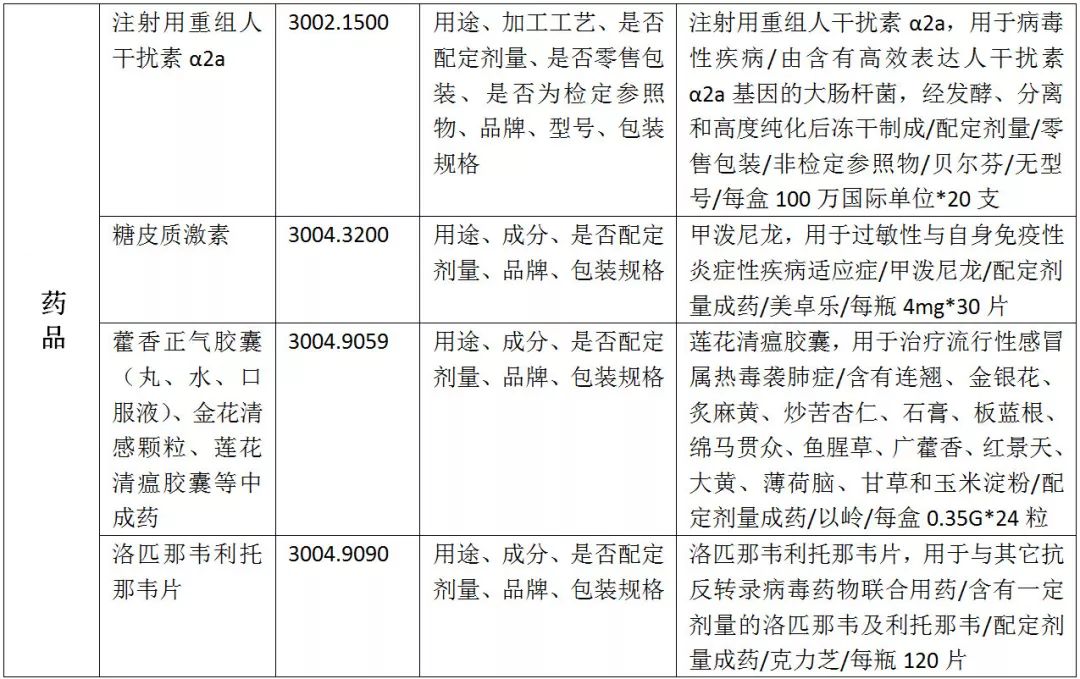

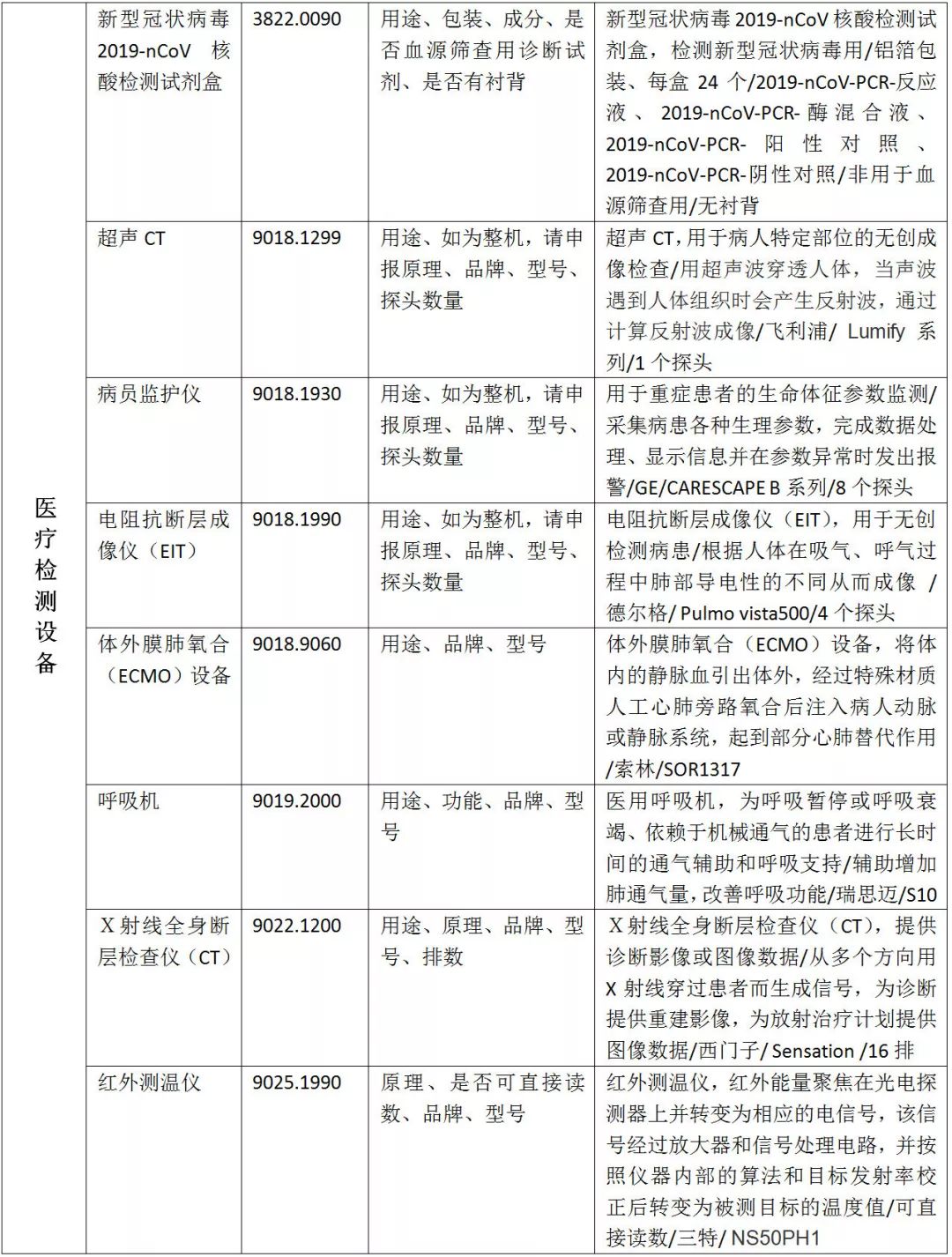
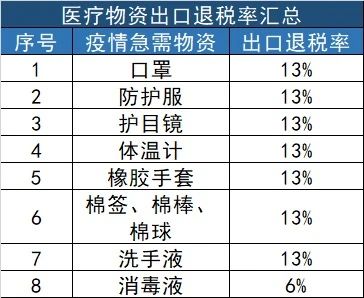
02、医疗物资出口退税率
◆◆口罩出口所需相关资质◆◆
国内出口贸易企业需具备的资质和材料:
1.营业执照(经营范围有相关经营内容)
2.企业生产许可证(生产企业)
3.产品检验报告(生产企业)
4.医疗器械注册证(非医用不需要)
5.产品说明书(跟着产品提供)、标签(随附产品提供)
6.产品批次/号(外包装)
7.产品质量安全书或合格证(跟着产品提供)
8.产品样品图片及外包装图片
9.贸易公司须取得海关收发货人注册备案
国内出口口罩生产企业资质证明:
a.生产个人防护或者工业用非医疗器械管理的普通口罩,有进出口权的企业,可自行直接出口。
b.生产属于医疗器械管理的口罩用于出口,中国海关不需要企业提供相关资质证明文件,但一般进口国会要求生产企业提供产品三证,以证明该进口的商品在中国已合法上市,具体如下:
1.营业执照(经营范围包含有医疗器械相关,非医疗级别的物品不需要)
2.医疗器械产品备案证或者注册证
3. 厂家检测报告
生产企业有进出口权,可以自行出口,如没有进出口权,可以通过外贸代理进行出口销售。
此外,熔喷布不属于医疗器械,不需要医疗器械证明。
附:
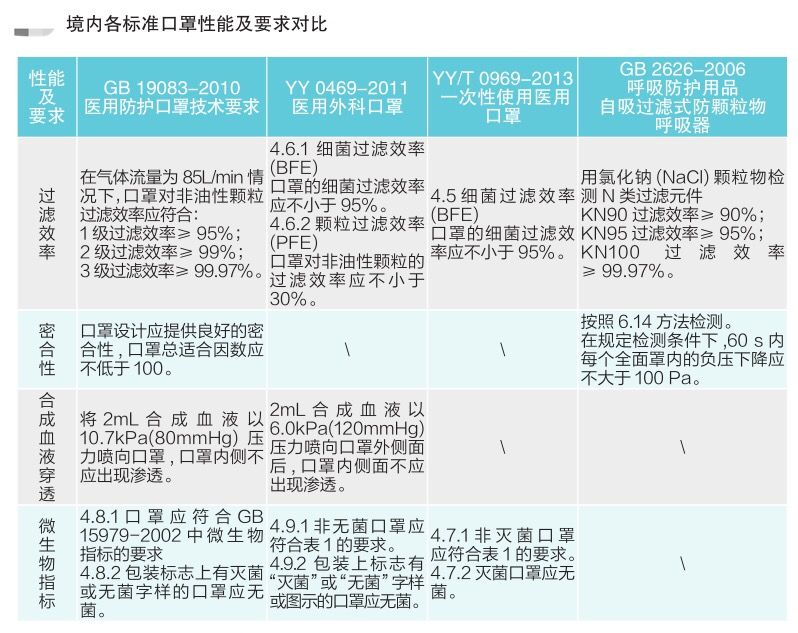
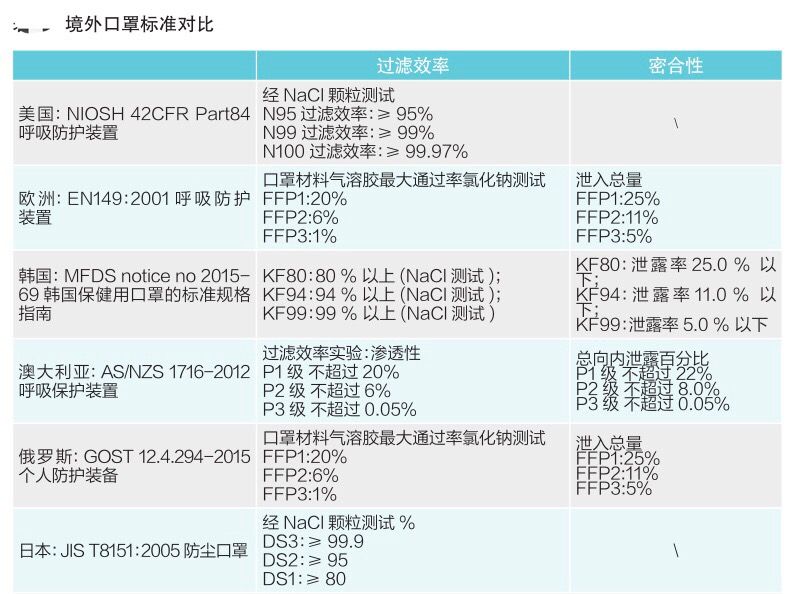
各国口罩技术标准对比
(供生产企业参考)

各国口罩技术标准
(供生产企业参考)
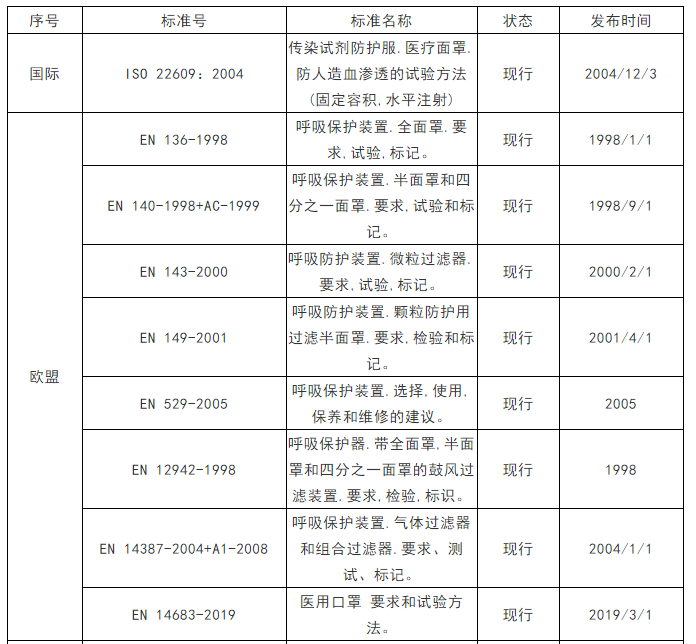

*以上技术标准如有动态调整,以相关标准管理机构官方发布为准。
◆◆额温枪◆◆

03、各国注册、认证简要办理流程
①、美国NIOSH认证
需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系部分资料)至NIOSH文审,只有文审和测试都通过,NIOSH才核发批文。NIOSH将其认证的防颗粒物口罩分为9类,具体的测试则由NIOSH下属的NPPTL (National Personal Protective Technology Laboratory)实验室操作。主要测试指标包括呼气阻力测试、呼气阀泄漏测试、吸气阻力测试、过滤效率测试。
②、美国FDA注册

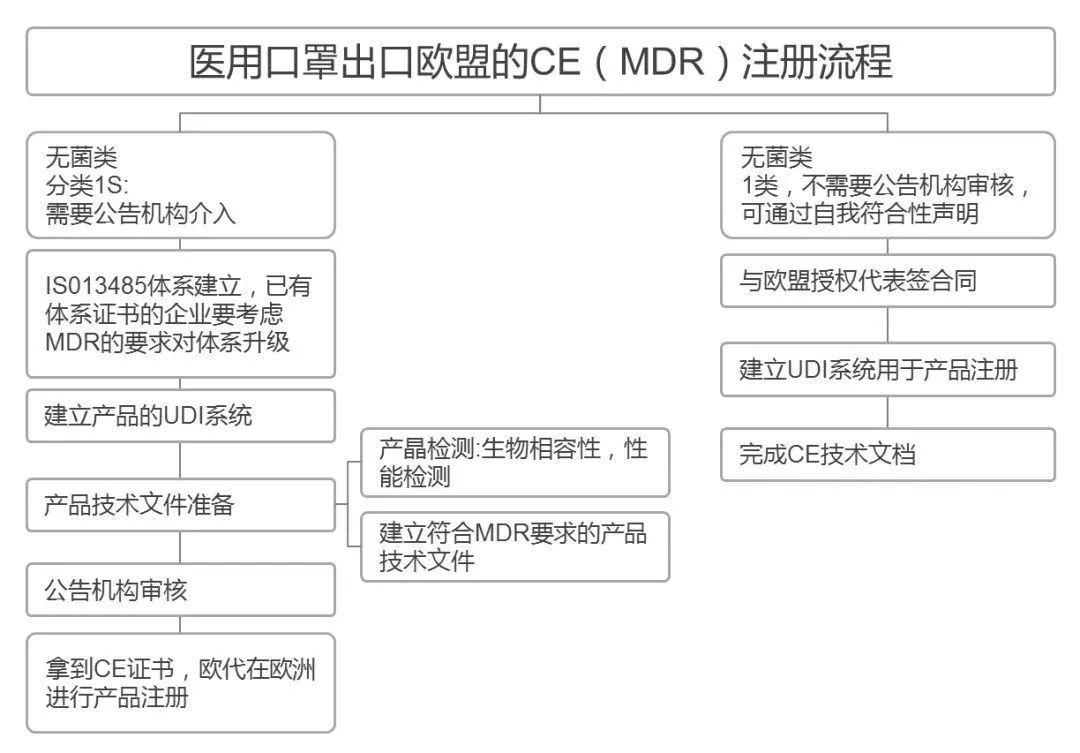
③、欧盟CE注册
④、日本PMDA注册
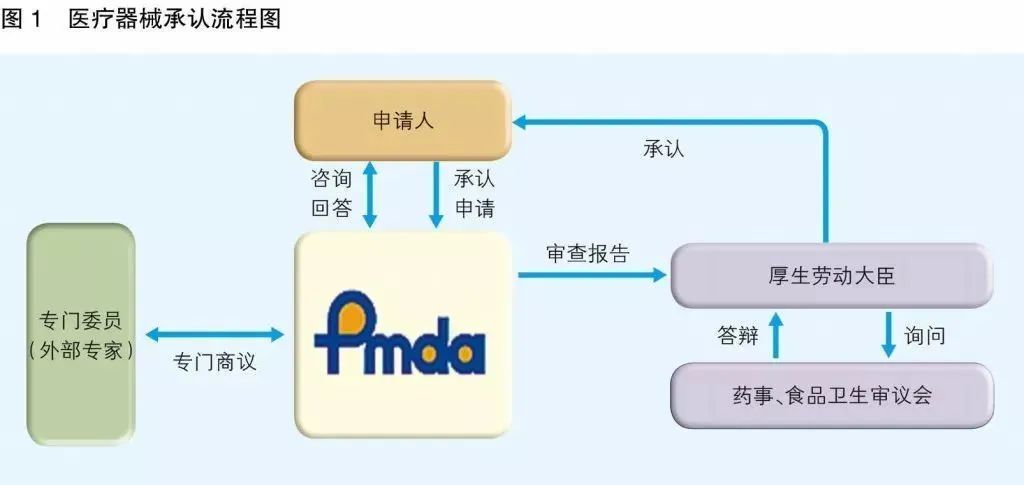
1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);
2. 制造商向PMDA注册工厂;
3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;
4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
⑤、韩国KFDA注册
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为:
1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);
2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;
3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;
4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 指定韩国代理商和经销商,产品销售。
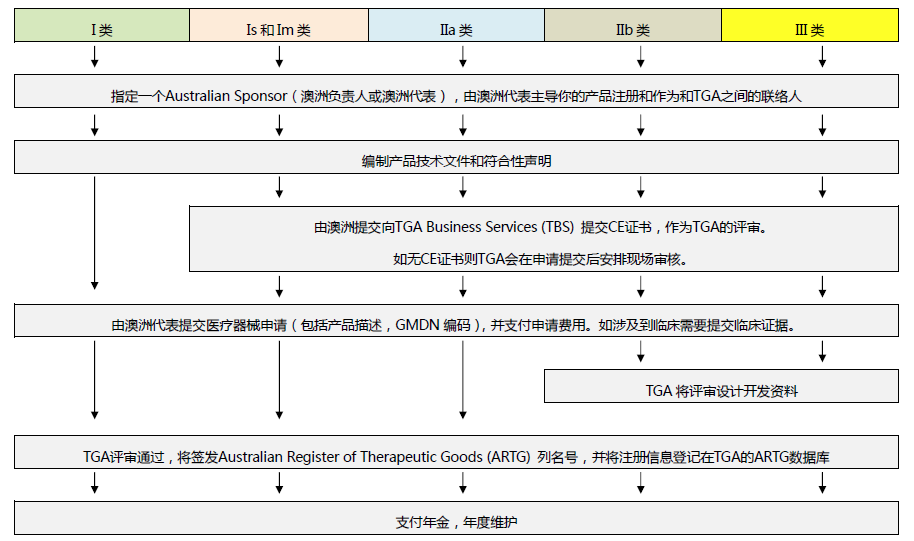
⑥、澳大利亚TGA注册
依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。如果已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。
⑦、伊朗
出口伊朗还是比较复杂的,需要在伊朗申请COI认证,中文为符合性核查,是伊朗进口强制发件要求的相关检查。
目前伊朗N95口罩和普通三层口罩、呼吸器、手术服、核酸检测试剂盒、个人防护用品、防护面罩和防护服等物资告急。
为鼓励进口,2月26日伊朗《经济在线》报道,伊朗市场口罩的进口关税从55%降到了5%。

Copyright 2020 yaoxie.com 互联网药品信息服务资格证书(闽)-经营性-2019-0023 互联网药品交易服务资格证书-国A20150004
闽ICP备14018699号-4 增值电信业务经营许可证 闽B2-20140006 闽公网安备35030502000131号 营业执照:91350300056126227U
医疗器械网络交易服务第三方平台备案凭证 备案编号:(闽)网械平台备字(2018)第00001号
药品网络交易第三方平台备案凭证 (闽)网药平台备字 (2023) 第000004-000号