毕井泉就任国家市场监管总局党组书记,原国家食药监总局副局长焦红出任国家药监局局长。中国药改方向,已能初窥。

21日下午4时,新组建的国家市场监管总局召开干部大会,总局领导班子已形成,其中:毕井泉出任国家市场监管总局党组书记,原国家工商总局局长张茅出任国家市场监管总局局长。另外,备受关注的国家药监局局长,由原国家食药监总局副局长焦红担任;有多年医疗卫生管理经验的原江西省副省长李利,出任国家药监局党组书记。
根据国务委员王勇的解读,此次组建的国家市场监管总局,在之前国家工商总局、国家质检总局、国家食药监总局“三合一”的基础上,进一步整合国家发改委的价格监督检查与反垄断执法,商务部的经营者反垄断执法以及原国务院反垄断委员会办公室的职责,以改革市场监管体系,实行统一的市场监管,是建立统一开放竞争有序的现代市场体系之关键环节。
但,考虑到药品监管的特殊性,单独组建国家药品监督管理局,由国家市场监督管理总局管理。
但做为中国药品审评审批改革的坚实推动者和药品生态铁腕的“变革者”,此次毕井泉出任国家市场监管总局的党组书记;国家药监局局长由具备多年地方药品监管经验的焦红出任,下一步中国药改方向已可管窥。在全新的大市场监管格局下:
新药审评审批将继续提速;
药(械)两票制将继续全国推进;
一致性评价或有微调;
医药代表备案制将强力推动;
医药行业商业贿赂治理、反垄断,将成为关注重点。
毕井泉继续推动药改
作为曾经CFDA的掌门人,毕井泉是中国药改最坚定的推动者。

毕井泉1955年9月出生,1982年2月北京大学经济学系毕业,后进修为北京大学中国经济研究中心高级管理人员工商管理硕士。在出任国家食品药品监督管理总局(简称“CFDA”)局长之前,担任国务院副秘书长7年;再之前,在发改委系统工作26年,位至国家发改委副主任。
2015年,毕井泉出任CFDA“掌门人”不久,国家药品审评审批综合改革启动。以2015年8月国务院印发《关于改革药品医疗器械审评审批制度的意见》为标志,毕井泉以“铁腕”姿态,带领CFDA陆续开启临床数据核查风暴,仿制药一致性评价;清理药品审评审批积压,对重大疾病,临床急需用药开启快速审评审批通道;重新定义新药,推动两办鼓励药物创新36条出台,重启中药注射剂再评价…志在重塑中国药品研发、生产、流通、使用生态。
在毕井泉在任的这三年,他重点实施的改革方案如下:
《国务院关于药品医疗器械审评审批制度改革的意见》
总局关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号)
《关于调整原料药、药用辅料和药包材审评审批事项的公告》(2017年第146号)
《关于进口药品注册审评审批有关事项的公告(征求意见稿)》意见
……
小编所列举的,仅是毕井泉在任两年半中,推进药改的一小部分新政。业界普遍认为,中国医药行业的变革,比过去30年的总和要多。这其中,既有国家“三医联动”改革的大环境要求,也有药品监管部门主政者的魄力。毕竟,医药行业的利益纠葛和部门之间、央地之间的博弈,比其他行业更为复杂。
在去年12月31日的新年致辞中,毕井泉曾有过这样的表述:2017年是食品药品监管系统开拓进取、砥砺奋进的一年,解决了许多长期想解决而没有解决的难题,办成了许多过去想办而没有办成的大事。
2018年,国务院机构改革突破太多人的预测和想象。而变革的核心,就是加强党的全面领导,不回避权力和利益调整,对传统既得利益进行整合,重塑新的利益格局;加强和完善政府经济调节、市场监管、社会管理、公共服务、生态环境保护职能,最大限度减少政府对市场资源的直接配置,最大限度减少政府对市场活动的直接干预。
药改的方向,符合上述改革原则,有理由相信,将在市场监管总局的统一领导下,继续深化推进。
这些药改具体事项值得期待
鼓励创新,对临床急需的新药审评审批提速,是大市场监管格局下,国家药监局不变的工作重点。
经过三年多的改革实践,可以总结出毕井泉执掌下的新时期CFDA监管思路的五个特点:
1、明确企业作为责任主体的身份,监管方逐渐退回至规则制定者的角色;
2、逐步建立基于风险的药品监管体系,强调事中和事后管理;
3、明确鼓励创新、提高药品质量的政策取向,严惩违法违规行为;
4、逐步建立公开、透明的沟通机制,强调业界和社会参与;
5、加速与国际监管标准接轨。
2017年6月22日,在第十二届全国人民代表大会常务委员会第二十八次会议上,毕井泉作为CFDA局长就国务院药品管理情况做报告。该报告被业界视为中国药品审评审批综合改革的持续深化方向,现在看来,仍有四大关键点:
1、继续提速药品审评审批,提高审评审批透明度,让临床急需的全球新药优先获准上市;
2、推进仿制药质量和疗效一致性评价;
3、提高药物临床研究质量;
4、推进药品上市许可持有人制度。
此外,去年中共中央办公厅、国务院办公厅印发的鼓励药物创新36条——《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》是上述四点的政策护航。
同步,小编从接近国家药监局和市场监管总局的相关人士处了解到,289品种的一致性评价工作,或有进程上的调整。医药行业的贿赂治理、反垄断执法,是未来市场监管总局治下的重点之一。
附件:

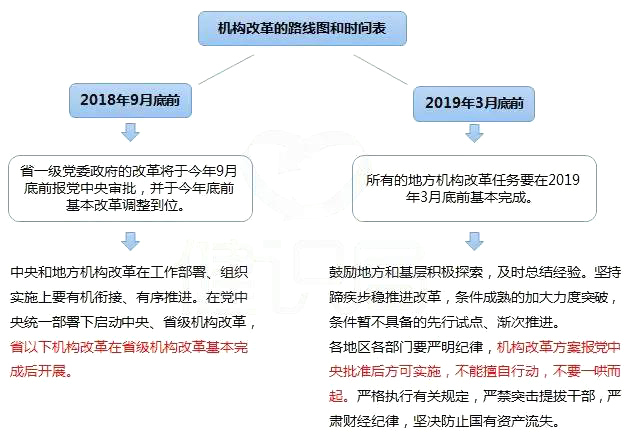
机构改革原则、路线图和时间表


Copyright 2020 yaoxie.com 互联网药品信息服务资格证书(闽)-经营性-2019-0023 互联网药品交易服务资格证书-国A20150004
闽ICP备14018699号-4 增值电信业务经营许可证 闽B2-20140006 闽公网安备35030502000131号 营业执照:91350300056126227U
医疗器械网络交易服务第三方平台备案凭证 备案编号:(闽)网械平台备字(2018)第00001号
药品网络交易第三方平台备案凭证 (闽)网药平台备字 (2023) 第000004-000号